พันธะไอออนิก ( Ionic bond ) หมายถึง พันธะระหว่างอะตอมที่อยู่ในสภาพอิออนที่มีประจุตรงกันข้ามกัน ซึ่งเกิดจากการเคลื่อนย้ายอิเล็กตรอน 11 ตัว หรือมากกว่า จากอิเล็กตรอนวงนอกสุดของอะตอมหนึ่งไปยังอีกอะตอมหนึ่ง เพื่อให้จำนวนอิเล็กตรอนวงนอกสุด ครบออกเตต ซึ่งเกิดขึ้นระหว่างอะตอมของโลหะกับอโลหะ โดยที่โลหะเป็นฝ่ายจ่ายอิเล็กตรอนในระดับพลังงานชั้นนอกสุดให้กับอโลหะ
เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ และอโลหะมีค่าพลังงานไอออไนเซชันสูง ดังนั้นพันธะไอออนิกจึงเกิดขึ้นระหว่างโลหะกับอโลหะได้ดี กล่างคือ อะตอมของโลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ แล้วเกิดเป็นไอออนบวกและไอออยลบของอโลหะ เพื่อให้เวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน ไอออนบวกกับไอออนลบจึงดึงดูดระหว่างประจุไฟฟ้าต่างกันเกิดเป็นสารประกอบไอออนิก( Ionic compuo) ดังนี้
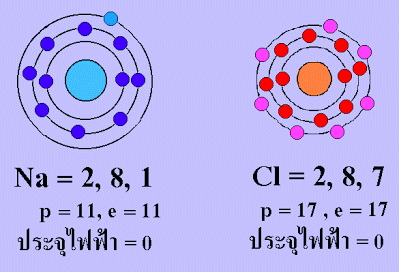
การเกิดสารประกอบโซเดียมคลอไรด์ ( NaCl ) จากโซเดียม (Na) อะตอมกับคลอรีน (Cl) อะตอม
โซเดียมเสียอิเล็กตรอนให้แก่คลอรีน 1 ตัว ทำให้อะตอมของโซเดียมมีเวเลนต์อิเล็กตรอน= 8 (อะตอมจะเถียร
เป็นไปตามกฎออกเตต) และทำให้มีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 1 ตัว ทำให้อะตอมโซเดียมแสดงอำนาจไฟ
เป็นประจุบวก(+) ส่วนอะตอมคลอรีนรับอิเล็กจากโซเดียมมา 1 ตัว ทำให้อะตอมของคลอรีนมีเวเลนต์อิเล็กตรอน = 8
(อะตอมเสถียรเป็นไปตามกฎออกเตต) และทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตรอน 1 ตัว ทำให้อะตอม
คลอรีนแสดงอำนาจไฟฟ้าเป็นประลบ(-)
โซเดียมอิออนบวก(+) และคลอไรด์อิออน (-) จะดึงดูดกัน เพราะมีประจุไฟฟ้าทีต่างกัน เกิดเป็น "พันธะไอออนิก"
อะตอมแมกนีเซียมมีการจัดเรียงอิเล็กตรอนเป็น Mg = 2, 8, 2 แมกนีเซียมมีเวเลนต์อิเล็กตรอน = 2 ดังนั้น
แมกนีเซียมจะจ่ายอิเล็กตรอนให้แก่คลอรีนอะตอม 2 ตัว เพื่อให้เวเลนต์อิเล็กตรอนเป็น 8 จึงจะเสถียรเหมือนก๊าซเฉื่อย
ทำให้อะตอมของแมกนีเซียมมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 2 ตัว จึงแสดงอำนาจไฟฟ้าเป็นประจุ 2+
แมกนีเซียมไอออนบวก(Mq 2+)และคลอไรด์ไอออนลบ(Cl -) จะเกิดแรงดึงดูดกัน เพราะมีประจุไฟฟ้าต่างกันเป็น
โมเลกุลของแมกนีเซียมคลอไรด์
โมเลกุลของแมกนีเซียมคลอไรด์
การเกิดพันธะไอออนิกในสารประกอบ แบเรียมออกไซด์ ( BaO )
การจัดเรียงอิเล็กตรอนของแบเรียม Ba = 2, 8, 18, 18, 8, 2 ( Ba มีเวเลนต์อิเล็กตรอน = 2 ) และการ
จัดเรียงอิเล็กตรอนของออกซิเจน O = 2, 6 ( O มีเวเลนต์อิเล็กตรอน = 6 ) Ba เสียอิอล็กตรอนให้ O จำนวน 2 ตัว
Ba จึงมีประจุเป็น 2+ ส่วน O ได้รับอิเล็กตรอนมา2 ตัว จึงมีประจุไฟฟ้าเป็น 2- เกิดแรงยึดเหนี่ยวด้วยประจุไฟฟ้า
ต่างกัน เป็นโมเลกุลของแบเรียมออกไซด์
ลักษณะสำคัญของสารประกอบไอออนิก 1. พันธะไอออนิกเป็นพันธะที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI 2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไน
เซชันสูง 3. พันธะไอออนิก อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น
สลับกัน ไม่สามารถแบ่งแยกเป็นโมเลกุลเดี่ยวๆได้ ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่างๆใน 1
โมเลกุลได้ แต่สามารถหาอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น จึงไม่สามารถเขียนสูตรโมเลกุลของ
สารประกอบไอออนิกได้ ใช้สูตรเอมพิริคัลแทนสูตรเคมีของสารประกอบไอออนืก
อะตอมของโลหะจะให้(จ่าย,เสีย)เวเลนต์อิเล็กตรอนแก่อะตอมของอโลหะ ดังนั้นธาตุหมู่ 1A ซึ่งมีเวเลนต์อิเล็กตรอน
เท่ากับ 1 จึงเกิดเป็นไอออนที่มีประจุ +1 ธาตุหมู่ 2 ซึ่งมีเวเลนต์อิเล็กตรอนเท่ากับ 2 เมื่อเกิดเป็นไอออนจะมีประจุ +2
เป็นต้น ส่วนอโลหะซึ่งมีจำนวนเวเลนต์อิเล็กตรอนใกล้เคียงกับก๊าซเฉื่อยจะรับอิเล็กตรอนมาให้ครบแปด เช่น ธาตุหมู่ 7A
จะรับอิเล็กตรอน 1 ตัว เมื่อกลายเป็นไอออนจะมีประจุ -1 สำหรับธาตุหมู่ 5 และหมู่ 6 เมื่อเกิดเป็นไอออนจะมีประจุ -3
และ -2ตามลำดับ เนื่องจากสามารถรับอิเล็กตรอนได้ 3 และ 2 อิเล็กตรอนแล้วมีการจัดเรียงอิเล็กตรอนตามกฎออกเตต
ก. การเขียนสูตรสารประกอบไอออนิก ใช้หลักดังนี้ 1. เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบของอโลหะหรือกลุ่ม
ไอออนลบ 2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหา
ตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของ
แต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน 3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวา
ล่าง ดังตัวอย่าง
จัดเรียงอิเล็กตรอนของออกซิเจน O = 2, 6 ( O มีเวเลนต์อิเล็กตรอน = 6 ) Ba เสียอิอล็กตรอนให้ O จำนวน 2 ตัว
Ba จึงมีประจุเป็น 2+ ส่วน O ได้รับอิเล็กตรอนมา2 ตัว จึงมีประจุไฟฟ้าเป็น 2- เกิดแรงยึดเหนี่ยวด้วยประจุไฟฟ้า
ต่างกัน เป็นโมเลกุลของแบเรียมออกไซด์
ลักษณะสำคัญของสารประกอบไอออนิก 1. พันธะไอออนิกเป็นพันธะที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI 2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไน
เซชันสูง 3. พันธะไอออนิก อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น
4. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สตรเอมพิริคัล ( สูตรอย่างง่าย ) 5.สารประกอบไอออนิกมีจุดดือดและจุดหลอมเหลวสูง 6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดัง
นั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้ เกิดเป็นสารอิเล็กโทรไลดต์จึงนำ
ไฟฟ้าได้
นั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้ เกิดเป็นสารอิเล็กโทรไลดต์จึงนำ
ไฟฟ้าได้
โครงสร้างของสารประกอบไอออนิก
โครงสร้างของสารประกอบไอออนิกมีลักษณะเป็นโครงผลึกร่างตาข่าย ประกอบด้วยไอออนบวกและไอออนลบสลับกัน ไม่สามารถแบ่งแยกเป็นโมเลกุลเดี่ยวๆได้ ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่างๆใน 1
โมเลกุลได้ แต่สามารถหาอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น จึงไม่สามารถเขียนสูตรโมเลกุลของ
สารประกอบไอออนิกได้ ใช้สูตรเอมพิริคัลแทนสูตรเคมีของสารประกอบไอออนืก
สารประกอบไอออนิก
เมื่อโลหะทำปฏิกิริยากับอโลหะ ธาตุทั้งสองจะรวมกันด้วยพันธะไอออนิกเกิดเป็นสารประกอบไอออนิก โดยอะตอมของโลหะจะให้(จ่าย,เสีย)เวเลนต์อิเล็กตรอนแก่อะตอมของอโลหะ ดังนั้นธาตุหมู่ 1A ซึ่งมีเวเลนต์อิเล็กตรอน
เท่ากับ 1 จึงเกิดเป็นไอออนที่มีประจุ +1 ธาตุหมู่ 2 ซึ่งมีเวเลนต์อิเล็กตรอนเท่ากับ 2 เมื่อเกิดเป็นไอออนจะมีประจุ +2
เป็นต้น ส่วนอโลหะซึ่งมีจำนวนเวเลนต์อิเล็กตรอนใกล้เคียงกับก๊าซเฉื่อยจะรับอิเล็กตรอนมาให้ครบแปด เช่น ธาตุหมู่ 7A
จะรับอิเล็กตรอน 1 ตัว เมื่อกลายเป็นไอออนจะมีประจุ -1 สำหรับธาตุหมู่ 5 และหมู่ 6 เมื่อเกิดเป็นไอออนจะมีประจุ -3
และ -2ตามลำดับ เนื่องจากสามารถรับอิเล็กตรอนได้ 3 และ 2 อิเล็กตรอนแล้วมีการจัดเรียงอิเล็กตรอนตามกฎออกเตต
ธาตุหมู่
|
I
|
II
|
II
|
IV
|
V
|
VI
|
VII
|
ประจุบนไอออน
|
+1
|
+2
|
+3
|
-4
|
-3
|
-2
|
-1
|
การเขียนสูตรและการเรียกชื่อสารประกอบไอออนิก
ไอออนลบ 2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหา
ตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของ
แต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน 3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวา
ล่าง ดังตัวอย่าง
จงเขียนสูตรของสารประกอบไอออนิกต่อไปนี้ ก. Na+ กับ O2- ข. Ca2+ กับ Cl- ค. NH4+ กับ SO42-
ข. การอ่านชื่อสารประกอบไอออนิก 1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อ
โลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
โลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
| อออซิเจน เปลี่ยนเป็น ออกไซด์ (oxide) |
ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride)
|
คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride)
|
ไอโอดีน เปลี่ยนเป็น ไอโอไดด์ (iodide)
|
ตัวอย่างการอ่านชื่อสารประกอบไอออนิกธาตุคู่
NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr)
|
CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide)
|
KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide)
|
CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride)
|
ถ้าสารประกอบที่เกิดจากธาตุโลหะเดีนวกันที่มีไอออนได้หลายชนิด รวมตัวกับอโลหะ ให้อ่านชื่อโลหะที่เป็น
ไอออนบวกแล้วตามด้วยค่าประจุของไอออนของโลหะโดยวงเล็บเป็นเลขโรมัน แล้วตามด้วยอโลหะที่เป็นไอออนลบ
โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น Fe เกิดไอออนได้ 2 ชนิดคือ Fe 2+ และ Fe 3+ และCu เกิดอิออนได้ 2
ชนิดคือ Cu + และ Cu 2+ สารประกอบที่เกิดขึ้นและการอ่านชื่อ ดังนี้
ไอออนบวกแล้วตามด้วยค่าประจุของไอออนของโลหะโดยวงเล็บเป็นเลขโรมัน แล้วตามด้วยอโลหะที่เป็นไอออนลบ
โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น Fe เกิดไอออนได้ 2 ชนิดคือ Fe 2+ และ Fe 3+ และCu เกิดอิออนได้ 2
ชนิดคือ Cu + และ Cu 2+ สารประกอบที่เกิดขึ้นและการอ่านชื่อ ดังนี้
FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II) chloride )
|
CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I) sunfide )
|
FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron (III) chloride )
|
Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์ ( Copper (II) sunfide )
|
2. สารประกอบธาตุสามหรือมากกว่า ถ้าสารประกอบเกิดจากไอออนบวกของโลหะ หรือกลุ่มไอออนบวกรวม
ตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
สารประกอบไอออนิกบางชนิดละลายน้ำได้ดีและบางชนิดไม่ละลายน้ำ การที่สารประกอบไอออนิกละลายน้ำได้
เนื่องจากแรงดึงดูดระหว่างโมเลกุลของน้ำกับไอออนมีค่ามากกว่าแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ เช่น
เมื่อนำโซเดียมคลอไรด์มาละลายในน้ำ แรงดึงดูดระหว่างโมเลกุลของน้ำกับโซเดียมไอออน และน้ำกับคลอไรด์ไอออนมี
ค่าสูงกว่าแรงยึดเหนี่ยวระหว่างไอออนทั้งสอง โซเดียมคลอไรด์จึงละลายน้ำได้ เมื่อไอออนเหล่านี้หลุดออกจาก
โครงสร้างเดิม แต่ละไอออนจะถูกล้อมรอบด้วยโมเลกุลของน้ำหลายๆโมเลกุล โดยน้ำจะหันขั้วที่มีประจุตรงกัน
ข้ามเข้าไอออนที่ล้อมรอบ
ในการละลายน้ำของสารประกอบไอออนิก จะมีขั้นย่อยๆของการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้ ขั้นที่ 1 ผลึกของสารประกอบไอออนิกสลายตัวออกเป็นไอออนบวกและลบในภาวะก๊าซ ขั้นนี้ต้องใช้พลังงานเพื่อ
สลายผลีก พลังงานนี้เรียกว่า พลังงานโครงร่างผลึก ( latece energy ) , E1 ขั้นที่ 2 ไอออนบวกและไอออนลบในภาวะก๊าซรวมตัวกับน้ำ ขั้นนี้มีการคายพลังงาน พลังงานที่คายออกมาเรียก
ว่า พลังงานไฮเดรชัน (Hydration energy ) , E2 พลังงานของการละลาย ( D E) มีค่า = E1 + E2 พลังงานของการละลายพิจารณาจากพลังงานโครงร่างผลึก (
E1 ) และพลังงานไฮเดรชัน( E2 ) ดังนี้
ตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonatX
|
KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae)
|
Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide)
|
(NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium pospate)
|
การละลายของสารประกอบไอออนิก
เนื่องจากแรงดึงดูดระหว่างโมเลกุลของน้ำกับไอออนมีค่ามากกว่าแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ เช่น
เมื่อนำโซเดียมคลอไรด์มาละลายในน้ำ แรงดึงดูดระหว่างโมเลกุลของน้ำกับโซเดียมไอออน และน้ำกับคลอไรด์ไอออนมี
ค่าสูงกว่าแรงยึดเหนี่ยวระหว่างไอออนทั้งสอง โซเดียมคลอไรด์จึงละลายน้ำได้ เมื่อไอออนเหล่านี้หลุดออกจาก
โครงสร้างเดิม แต่ละไอออนจะถูกล้อมรอบด้วยโมเลกุลของน้ำหลายๆโมเลกุล โดยน้ำจะหันขั้วที่มีประจุตรงกัน
ข้ามเข้าไอออนที่ล้อมรอบ
ในการละลายน้ำของสารประกอบไอออนิก จะมีขั้นย่อยๆของการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้ ขั้นที่ 1 ผลึกของสารประกอบไอออนิกสลายตัวออกเป็นไอออนบวกและลบในภาวะก๊าซ ขั้นนี้ต้องใช้พลังงานเพื่อ
สลายผลีก พลังงานนี้เรียกว่า พลังงานโครงร่างผลึก ( latece energy ) , E1 ขั้นที่ 2 ไอออนบวกและไอออนลบในภาวะก๊าซรวมตัวกับน้ำ ขั้นนี้มีการคายพลังงาน พลังงานที่คายออกมาเรียก
ว่า พลังงานไฮเดรชัน (Hydration energy ) , E2 พลังงานของการละลาย ( D E) มีค่า = E1 + E2 พลังงานของการละลายพิจารณาจากพลังงานโครงร่างผลึก (
E1 ) และพลังงานไฮเดรชัน( E2 ) ดังนี้
1.ถ้าค่า D E< 0 ( E1 < E2 ) การละลายจะเป็นแบบคายพลังงาน
2. ถ้าค่าD E > 0 ( E1 > E2 ) การละลายจะเป็นแบบดูดพลังงาน
3.ถ้าD E = 0 ( E1 = E2 ) การละลายจะไม่คายพลังงาน
4.ถ้า พลังงานโครงร่างผลึกมีค่ามากกว่าพลังงานไฮเดรชันมากๆ ( E1 >>>> E2 ) จะไม่ละลายน้ำ












ไม่มีความคิดเห็น:
แสดงความคิดเห็น